Смесители, реакторы
Установки приготовления и дозирования растворов реагентов
Реагентные методы обработки
1. Технология химической (реагентной) обработки сточных вод, содержащих аммиакатные комплексы цинка, меди, никеля и кадмия
Сточные воды, содержащие аммиакаты тяжёлых металлов, являются специфичными, т. к. осаждение цинка, меди, никеля и кадмия из аммиакатных комплексов в виде гидроксидов в интервале рН, оптимальном для обработки кислотно-щелочных сточных вод, происходит не полностью.
Высокое оптимальное значение рН гидратообразования кадмия в содержащих аммиакатные комплексы Cd сточных водах обусловливает необходимость обработки их отдельным от кислотно-щелочных стоков потоке. На рис. 1 представлены графики, характеризующие зависимость остаточной концентрации ионов Cd(II) от рН при различных степенях разбавления исходного электролита.
Графики, характеризующие зависимость остаточной концентрации ионов Cd(II) от рН при различных степенях разбавления исходного электролита
Рис. 1. Графики, характеризующие зависимость остаточной концентрации ионов Cd(II) от рН при различных степенях разбавления исходного электролита
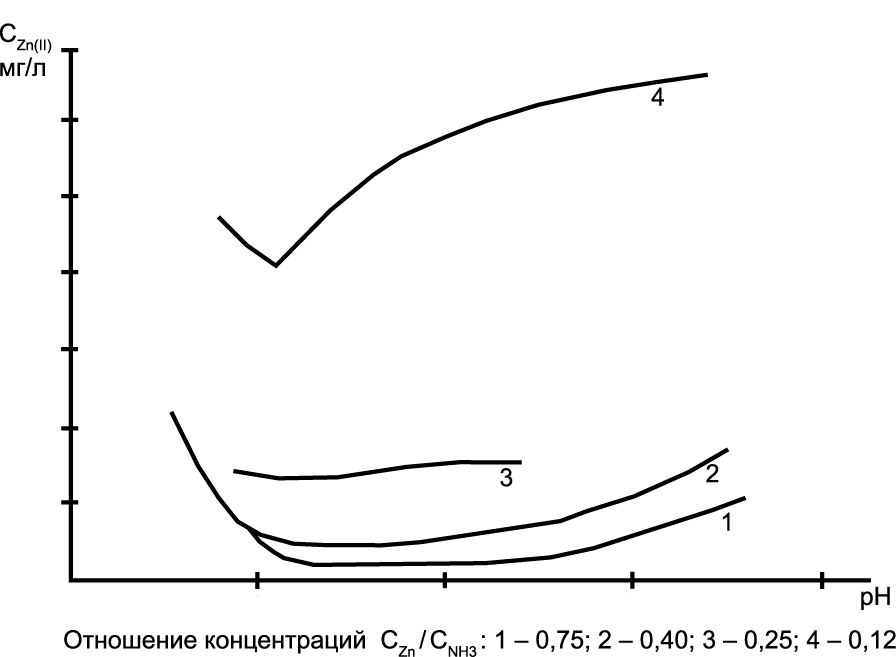
Эффективность щелочной обработки сточных вод, содержащих аммиакатные комплексы цинка, зависит от соотношений концентраций металла и аммиака в растворе (рис. 2) и от степени разбавленности стока (рис. 3). При обработке необходимо поддерживать величину рН в строго определeнном интервале вследствие амфотерности металла.
Рис. 2. Вид зависимостей остаточных концентраций Zn(II) от рН при различных соотношениях концентраций Zn и NH3
Рис. 3.Влияние степени разбавления исходного аммиакатного электролита цинкования на эффективнось реагентной обработки при различных значениях рН
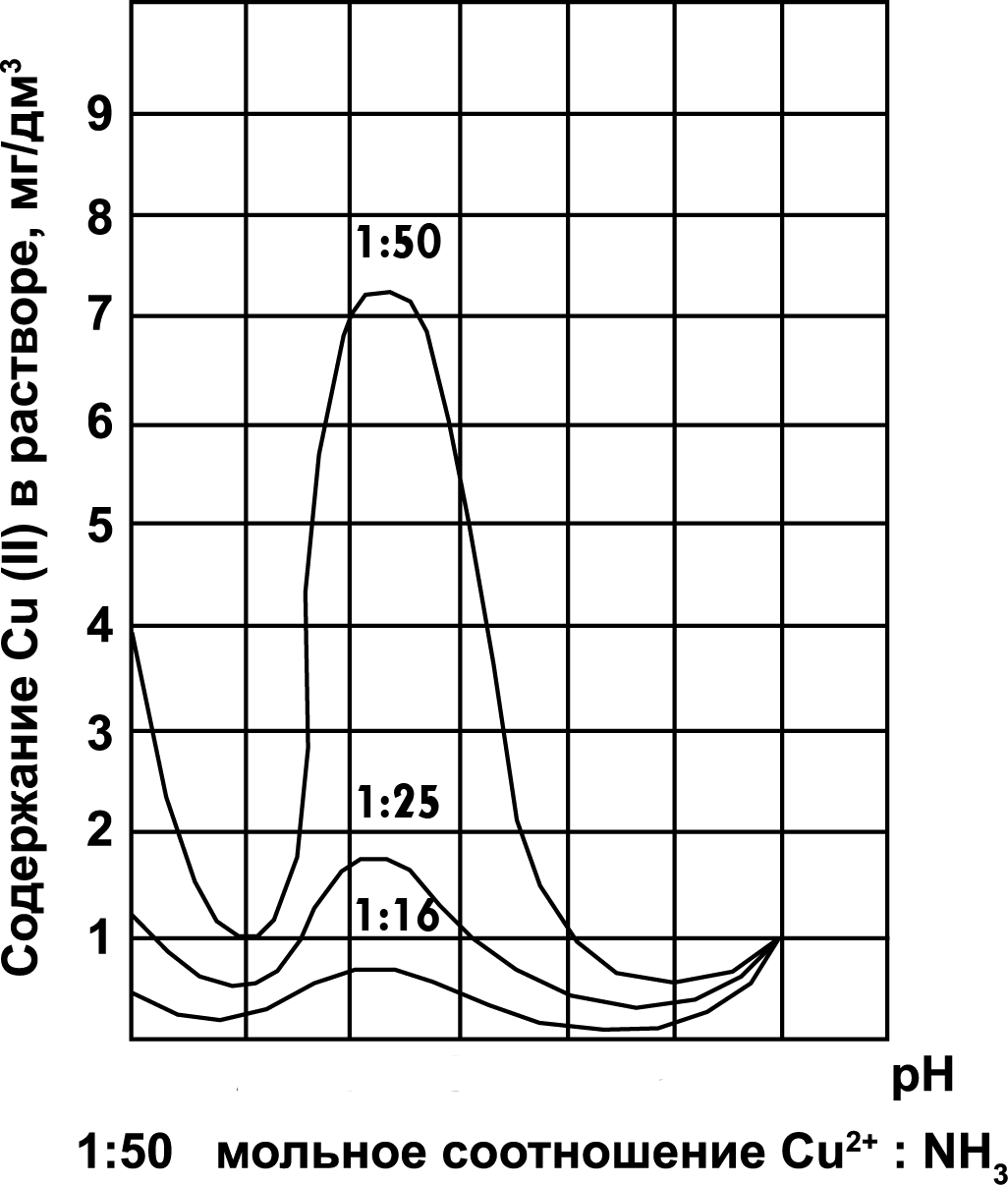
Содержащие медь аммиакатные сточные воды можно обрабатывать совместно с общим кислотно-щелочным потоком, если концентрация аммиака в воде не превышает 200 мг/л, в противном случае – отдельным потоком при высоких значениях рН. На рис. 4 показано поведение меди при обработке при разных мольных соотношениях Cu:NH3 (1:16, 1:25, 1:50).
Рис. 4. Вид зависимости остаточных концентраций Cu(II) от рН при различных мольных соотношениях ионов меди и аммиака. Над графиками указано мольное соотношение.
Обработку содержащих никель аммиакатных сточных вод следует производить отдельно от не содержащих аммиакаты потоков и можно обрабатывать совместно с Cd-содержащими и Cu-содержащими аммиакатными стоками при высоких значениях рН.
Жесткие условия для достижения необходимого эффекта очистки исключают возможность сброса концентрированных технологических растворов, содержащих аммиакаты тяжелых металлов (по техническим условиям на осуществление процессов аммиакатного кадмирования, цинкования, никелирования и меднения электролиты сбрасываться не должны).
Электрохимическая очистка сточных вод, содержащих аммиакаты тяжелых металлов, по результатам наших экспериментальных исследований оказывается неприменимой по экономическим соображениям.
Ионообменная очистка сточных вод, содержащих аммиакаты тяжелых металлов, по результатам наших исследований неэффективна и практически нереализуема.
2. Технология очистки сточных вод от ионов тяжёлых металлов методом ферритизации
Ферриты впервые стали известны в 1909г.
Интерес к этим материалам появился и стал быстро расти гораздо позднее в связи с развитием импульсной и высокочастотной техники. Ферриты металлов получают обычно спеканием смеси порошковых окислов различных металлов. Меньшее распространение ввиду недостаточной изученности получил «мокрый» способ, заключающийся в совместном осаждении из растворов гидроксидов металлов и последующем обезвоживании их. В дальнейшем было выяснено, что при совместном существовании в водном растворе ионов железа (Fe2+) с ионами других металлов (Ме2+) добавление эквивалентного количества щёлочи вызывает следующую реакцию:
хМе2+ + (3 – х)Fe2+ + 6OH- → MexFe3-x(OH)6
Окисление смешанной гидроокиси при при соответствующих условиях приводит к образованию феррита – соединения чёрного или бурого цвета, имеющего структуру шпинели:
MexFe3-x(OH)6 + O2 → MexFe3-xO4
Простейшим видом феррита является магнетит Fe3O4 (или FeO•Fe2O3), также имеющий структуру шпирели, где каждый ион кислорода связан с Fe2+ и Fe3+ в промежутках гранецентрированной кубической решётки с плотной упаковкой.
Без изменения кристаллической структуры магнетита, путём замещения в нём части ионов железа ионами тяжёлых металлов формируется твёрдое вещество – феррит.
Устойчивость подобных химических соединений тяжёлых металлов в воде подтолкнула исследователей к разработке метода удаления тяжёлых металлов из растворов, в частности, из сточных вод путём превращения их в ферритные осадки.
Ферритная очистка сточных вод применительно к ионам тяжёлых металлов была впервые предложена японскими исследователями в 1972 году и запатентована в Японии и США в 1976г.
В соответствии с первоначальной заявкой Японии для удаления из сточных вод титана, ванадия, хрома, марганца, железа, кобальта, никеля, меди, цинка, кадмия, олова, ртути, висмута, алюминия и магния добавляют железо (II) в количестве 2 – 100 г-ионов на 1г-ион содержащихся в растворе ионов тяжёлых металлов и едкую щёлочь в количестве, эквивалентном содержанию кислот. Затем через сточную воду продувают кислородсодержащий газ для окисления Fe(II) и превращения Fe(OH)2 в Fe3O4 или FeOOH, которые удаляют магнитной сепарацией (магнетит и ферриты обладают магнитными свойствами). Железо вводят в виде железного купороса в избыточном количестве, более чем вдвое превышающем общее содержание тяжёлых металлов. В качестве газа-окислителя используют кислород или воздух, обработку сточной воды проводят при 60οС. В последующие годы появились публикации самого разнообразного характера, касающиеся детальной разработки процесса ферритизации в интервале температур от 60ο до 120οС.
Фирмой Mitsubishi Petrochemical Co Ltd был предложен электрохимический вариант ферритной обработки стоков, заключающийся в электролизе с растворимым железным анодом в присутствии кислорода воздуха с последующим магнитным разделением фаз. Предлагаемый способ позволяет снизить содержание шестивалентного хрома в сточных водах при их расходе 12 куб.м в сутки с 200 до 0,05 мг/л. Далее электрохимическая ферритизация была разработана для катионов других тяжёлых металлов (Cd, Cu, Fe, Zn, Pb, Mn, Hg), а также для удаления цианидов,органических загрязнений, суспензий, SiO2, красителей.
Однако, следует отметить, что в промышленных условиях высокотемпературная ферритизация целесообразна лишь при наличии на предприятиях достаточного количества неиспользованного тепла или в случае небольших объёмов сточных вод. В связи с этим широкое развитие получает ферритная технология обезвреживания стоков при обычной температуре. Для того, чтобы ферритный метод можно было использовать на практике при обычной температуре, необходимо выполнение следующих условий:
- получать стабильный при обычной температуре феррит;
- диаметр частиц феррита, образующегося при обработке, должен быть достаточно велик (иначе затруднено их отделение;
- время обработки должно быть ограничено (от этого зависятобъёмы реакторов).
Для относительно низких температур (от 0ο до 25οС ) разработан способ, отличающийся тем, что вместе с раствором сульфата двухвалентного железа в обрабатываемую воду вводят определённое количество порошкообразного магнетита, частицы которого играют роль первичных центров образования ферритов. Для интенсификации образования осадка проводят принудительную продувку раствора воздухом.
Операцию окисления кислородом воздуха, как показали исследования, можно осуществлять на смачиваемой поверхности. Использование вертикальных смачиваемых поверхностей позволило разработать компактную установку, время окисления в которой составило 2 часа.
К сокращению времени обработки приводит способ, заключающийся в том, что к сточной воде добавляют смесь солей двух- и трёхвалентного железа в определённом соотношении с последующим подщелачиванием.
Обработкой смеси растворов железа (II) и железа (III) щелочами был получен активированный феррит, обладающий улучшенными ферромагнитными характеристиками и адсорбционной способностью по отношению к ионам тяжёлых металлов. Отходы и промышленные сточные воды, содержащие ионы тяжёлых металлов, смешивают с активным ферритом, который хорошо сорбирует ионы Cr, Hg, Cd, Pb, As, Cu, Mn, Ni, Co, Be.
Извлечение адсорбированных тяжёлых металлов из феррита осуществляется обработкой его сильной кислотой при рН<2, после чего феррит снова может быть использован для очистки сточных вод.Аппаратурное оформление ферритной обработки отличается простотой, в его основе заложен принцип осаждения продуктов в магнитном поле.
Процесс очистки сточных вод путём образования ферритов имеет следующие отличительные особенности:
- возможность обработки сточных вод от разных гальванических процессов и процессов химобработки единым потоком;
- возможность одновременной надёжной очистки сточных вод от многих тяжёлых металлов, в том числе находящихся в воде в виде различных комплексов (аммиакатных, этилендиаминовых, пирофосфатных и др.); В отличие от применяющегося способа выделения металлов в виде гидроксидов данным способом возможно одновременное практически полное удаление их при одном значении рН без опасений вторичного растворения осадков. Тяжёлые металлы, удалённые из сточной воды этим способом, входят в кристаллическую структуру феррита, поэтому они образуют очень устойчивые химические соединения в отличие от осаждённых гидроксидов;
- осадки, образованные обычными методами, имеют такую тонкую структуру, что их трудно отфильтровать; и, наоборот, осадки, образованные ферритным методом, обладают хорошей способностью к осаждению и фильтрации, Кроме того, они могут быть отделены магнитными способами, т.к. они ферромагнитны;
- возможно удаление шестивалентного хрома без предварительного восстановления его до трёхвалентной формы;
- возможна очистка сточных вод с высокой концентрацией примесей (до нескольких десятков граммов на литр;
- возможно удаление загрязнений, находящихся в стоках в виде твёрдых частиц во взвешенном состоянии.
Очень большое влияние на качество и эффективность ферритной обработки сточных вод оказывает вид применяемого щелочного реагента (NaOH, Ca(OH)2, NaHCO3, NH4OH).
2.1. Условия канализования сточных вод.
Эффективное удаление тяжёлых металлов методом ферритной обработки обеспечивается для любых сточных вод, имеющихся на предприятии.
При использовании метода ферритизации сточные воды можно направлять на очистку общим потоком, включающим кислотно-щелочные, аммиакатсодержащие, хромсодержащие и другие стоки, содержащие катионы тяжёлых металлов. Предапрительная обработка хромсодержащих стоков с целью восстановления Cr6+ до Cr3+ не требуется. В отдельные потоки с очисткой по известным технологиям следует выделять только фтор- и циансодержащие сточные воды.
2.2. Удаление тяжёлых металлов из сточных вод методом низкотемпературной ферритизации
Метод низкотемпературной ферритизации заключается во введении в сточные воды солей двух- и трёхвалентного железа с последующим подщелачиванием реакционной смеси. Процесс может производиться в периодическом и непрерывном режимах.
На рис. 5 приведена одна из возможных принципиальных схем непрерывной очистки методом низкотемпературной ферритизации.
Сточные воды поступают в приёмный резервуар, из которого насосами подаются в смеситель, перед которым в поток (в напорную либо всасывающую линию насоса) дозируются комплексный железосодержащий и щелочной реагенты. Затем смесь направляется в реактор-флокулятор. Перед входом в реактор реакционная смесь через эжекторы насыщается воздухом для окисления избыточного Fe2+. Далее смесь поступает в отстойник, из которого очищенная вода после корректировки рН сбрасывается в канализацию, а осадок направляется на обезвоживание. Часть осадка из промежуточного бака подаётся в подогреватель для ускорения процесса кристаллизации ферромагнитных соединений, затем во флокулятор в качестве первичных центров кристаллизации и поддержания необходимой концентрации Feобщ
Технологические параметры процесса низкотемпературной ферритной обработки сточных вод:
- расчёт расхода железосодержащих реагентов производится на основе соотношения
Feобщ: ∑ТМ = (5 – 20) : 1,
где Feобщ – суммарное содержание Fe2+ и Fe3+ в комплексном железосодержащем реагенте,
∑ТМ - сумма концентраций тяжёлых металлов в промстоках.
Конкретное значение кратности из приведённого интервала принимается в зависимости от количества видов катионов металлов в воде;
- устойчивое образование ферромагнитных осадков происходит при концентрации железа (общего) в реакционной смеси не менее экспериментально определённой величины;
- в случаях обработки разбавленных сточных вод, когда минимально необходимая концентрация Feобщ не достигается добавлением расчётного количества комплексного железосодержащего реагента, в реактор вводятся ферромагнитные соединения. В качестве них используются ферромагнитные осадки, образовавшиеся в процессе очистки стоков, прошедших термообработку при температуре 80oС;
- количество осадка в процессах ферритной обработки сточных вод составляет 5 -10% от объёма стоков.
- осадок обладает магнитными свойствами, плотность высушенного осадка составляет 2,2 – 3,2 г/см3, влажность осадка после двухчасового отстаивания – 99,5 – 99,8%;
- химическая стойкость ферромагнитных осадков зависит от степени сформированности кристаллических структур ферромагнитных соединений и различна на разных стадиях технологического процесса ферритной обработки. Так, при рН = 1,5 растворяется 40% отстоенного осадка, 15% обезвоженного на вакуумфильтре и 2-3% высушенного осадка. Обычный гидроксидный осадок при таком значении рН растворяется полностью;
- процесс кристаллизации ферромагнитных осадков заканчивается полностью при их высушивании, аналогичные результаты даёт старение осадка в течение 15-20 суток в водной среде;
- кинетика осаждения ферромагнитных осадков существенно отличается от кинетики осаждения гидроксидных. Например, при скорости 0,5 мм/с выпадает 30-95% ферромагнитной взвеси и 25-30% гидроксидного осадка. Однако, вследствие полидисперсного состава образующихся ферромагнитных соединений их достаточно полное осаждение (на 98-99%) наблюдается при скоростях, равных скоростям полного осаждения гидроксидных осадков. Следовательно, для процессов ферритной обработки промстоков расчёт гравитационных отстойников следует производить так же, как и для обычной реагентной очистки сточных вод.
Разновидностью низкотемпературной («холодной») ферритизации является процесс, в котором окисление двухвалентного железа осуществляется нитритом натрия (NaNO2).
2.3. Удаление катионов тяжёлых металлов из сточных вод высокотемпературной ферритизацией
Суть высокотемпературной ферритизации заключается во введении в сточные воды солей двухвалентного железа при подщелачивании потока до рН=10…10,5, нагреве до 60-80oС и продувке смеси сжатым воздухом. Образующийся в результате такой обработки осадок по своему химическому составу представляет смесь оксигидратов железа, магнетита Fe3O4 и ферритов МехFe2x(OH)6
Ферритизация проводится в реакторе, куда подводится тепло и сжатый воздух.
Процесс ферритизации позволяет производить полное удаление тяжелых металлов, независимо от состава сточных вод. Образующийся осадок обладает магнитными свойствами , имеет кристаллическую структуру, стоек к воздействию щелочей и разбавленных кислот, т.е. не вызывает вторичного загрязнения окружающей среды при его захоронении, близок по своему составу к минералам железа. Такой осадок можно использовать в качестве первичных центров кристаллизации и поддержания концентрации железа в процессе ферритизации. Ферритный осадок используется для получения ферромагнитных суспензий и эмульсий, а также при производстве радиоволновых фильтров, его можно сдавать на переработку на предприятия черной металлургии.
Отделение осадка можно производить на магнитных барабанных сепараторах.


-v-razbavlennom-rastvore.png)